Disolución de Substancias Sólidas Minerales
en las Minas
Pablo Higueras
y
Roberto
Oyarzun
Uno de los problemas más serios de introducción de metales pesados en el medio acuoso, viene dado por la disolución de especies minerales que están en desequilibrio con las condiciones del medio que las contiene, por ejemplo, un sulfuro metálico en condiciones oxidantes. Este caso es particularmente importante en regiones del mundo donde existe o ha existido una importante industria minera. ¿Por qué centrar esta discusión en la minería? porque la minería constituye la fuente más importante metales en el mundo (una parte pequeña proviene de operaciones de reciclado). La minería, como cualquier otro proceso industrial, produce problemas en la calidad del agua en dos aspectos principales: 1) desarrollo del llamado drenaje ácido de mina como consecuencia de la oxidación y lixiviación (disolución) de las especies sulfuradas, lo que acarrea un descenso del pH y la contaminación de aguas, debido a la propia naturaleza de los materiales explotados, por ejemplo metales pesados tales como Cu, Pb, Zn-(Cd), As, Hg, etc. y aniones asociados (sulfatos, carbonatos, etc.); y 2) contaminación de las aguas debido al uso de técnicas de lixiviación en pila (heap leaching) de metales, donde el agente lixiviante puede ser el ácido sulfúrico (para el cobre) o el cianuro de sodio (para el oro). Analizaremos el primer caso en esta sección, y el segundo en la siguiente.
Sin duda, el mayor problema que representa la minería frente a las aguas es la formación del denominado drenaje ácido de mina, consistente en la formación de aguas de gran acidez, por lo general ricas en sulfatos, y con contenidos variables en metales pesados. Dicho drenaje se desarrolla a partir de la lixiviación de sulfuros metálicos o de pirita presente en carbones. Para ello existen dos fuentes principales: 1) el mineral sulfurado in situ (causa no antropogénica), y 2) las escombreras de minerales (mineral dumps) y balsas de estériles (tailings) abandonadas.

Drenaje ácido de mina. Note la fuerte coloración rojiza,
dada por especies oxidadas de hierro.
No obstante, en algunos casos los fenómenos naturales,
ejemplificados en el caso del Río Tinto (Huelva), pueden llegar a alcanzar
grandes proporciones. El drenaje ácido se produce por la oxidación e hidrólisis
de los sulfuros, y en especial de la pirita, mediante la serie de reacciones:
4 FeS2 + 14
O2 + 4 H2O → 4 Fe2+ + 8 SO42-
+ 8 H+
a su vez, los iones ferroso (Fe2+)
se oxidarán de la siguiente manera:
4 Fe2+ + O2
+ 4 H+ → 4 Fe3+ + 2 H2O
los iones férricos se hidrolizan para
formar goethita:
Fe3+ + 2 H2O → 4 FeO(OH) + 3 H+

Procesos naturales de oxidación de sulfuros
(principalmente pirita) en el yacimiento de Río Tinto (Huelva. España). El
color rojizo se deriva de la presencia masiva de goethita.
En climas muy áridos (Desierto de Atacama, Chile; Outback
de Australia), esta serie de reacciones puede quedar interrumpida dando origen
a sulfatos férricos tales como jarosita, copiapita o coquimbita.
A pesar de que estas reacciones pueden dar a entender que
suceden en condiciones puramente inorgánicas, el entorno biológico juega un
papel decisivo. Por ejemplo, la bacteria Thiobacillus ferrooxidans es la
mayor responsable de la contaminación relacionada con el drenaje ácido
procedente de explotaciones mineras y mineralizaciones en general. Esta es una
bacteria acidófila (propia de ambiente ácido), con una fisiología basada en la
fijación de carbono a partir del CO2 atmosférico, obteniendo su
energía a partir de oxidación del hierro (1) o azufre (2):
Fe2+ + 0.25
O2 + H+ → Fe3+ + 0.5 H2O (1)
H2S + 2 O2
→ SO42- + 2 H+ (2)
En ausencia de bacterias del tipo T. ferrooxidans, las reacciones de oxidación de los sulfuros se ven severamente ralentizadas.
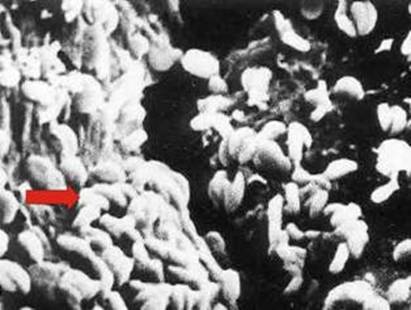
Bacterias T. ferrooxidans (flecha) adheridas a una partícula de sulfuro.
Otro factor que incide de manera
decisiva en la oxidación y lixiviación de sulfuros metálicos es la tasa de
producción de sulfato férrico:
Fe2(SO4)3 =
2 Fe3+ + 3 SO42-
el cual actúa como un potente agente
oxidante para minerales tales como la pirita (1) o calcopirita (2):
FeS2 + 14
Fe3+ 8 H2O → 15 Fe2+ + 2 SO42-
+ 16 H+ (1)
CuFeS2 + 16Fe3+ + 8 H2O → Cu2+ + 2 SO42- + 17 Fe2+ (2)
El problema ambiental derivado de estos procesos radica no solo en la liberación de cationes relativamente inocuos como Fe2+ o Fe3+, o en que aumente la acidez de las aguas. Aunque estos son dos problemas en sí, nos enfrentamos además a otro grave peligro para la salud humana y ambiental: el resto de los minerales sulfurados presentes en una escombrera o balsa de estériles también se oxidan, liberando metales pesados de altísima peligrosidad tales como (entre otros) el plomo (presente en galena, 1), el arsénico (presente en arsenopirita, 2 o enargita, 3), o el cadmio (presente en la fase de esfalerita, 4):
2 PbS + 4 Fe3+
+3 O2 + 2 H2O → 2 PbSO4 + 4 Fe2+
+ 4 H+ (1)
2 FeAsS + Fe2(SO4)3
→ 2 H3AsO4 + 4 FeSO4 + H2SO4
(2)
Cu3AsS4
+ 5.5 Fe2(SO4)3 + 4 H2O → 3
CuSO4 + 11 FeSO4 + 4 S + H3AsO4 +
2.5 H2SO4 (3)
Zn1-xCdxS
+ 8 Fe3+ + 4 H2O → 8 H+ + (1-x) Zn2+
+ (x) Cd2+ + SO42- + 14 Fe2+ (4)
Así, nos enfrentamos primariamente a un problema de
“mineralogía ambiental”, y en segundo lugar, a otro de “geoquímica ambiental”.
En ocasiones la opinión pública suele fijar sus críticas sobre el impacto
ambiental minero más evidente, esto es, la presencia en si de una mina (impacto
visual), olvidando los aspectos mineralógicos y químicos que se derivan de la
actividad como tal. Aquí hay varios temas a tratar: 1) la “mineralogía” del
yacimiento que se explota; 2) el o los “metales” presentes en esas fases
minerales; 3) los “procesos metalúrgicos” que se emplean para extraer el metal
o metales; y 4) el “clima” de la región. Obviamente no es lo mismo bajo
el punto de vista de la salud humana una explotación minera de hierro, que otra
de arsénico o plomo. La primera podrá generar importantes impactos visuales o
sociales, pero el hierro definitivamente no está dentro de la lista de
elementos químicos de alta peligrosidad. Así, el problema debe ser enfocado
primariamente en términos de la mineralogía del yacimiento que ha sido
explotado o se encuentra en explotación. Quisiéramos insistir sobre este último
punto. Continentes como el europeo registran una historia minera y metalúrgica
que se extiende, de manera importante, desde los tiempos del Imperio Romano.
Esta minería ha dejado un legado, muchas veces oculto, de escombreras de
minerales que con el pasar de los siglos han sido “disimuladas” por la acción
de la naturaleza o actividades humanas.

Escombreras y lodos estériles en el Distrito de
La carga mineral que no se explotó en su momento por
razones de atraso tecnológico, o por las mismas, se explotó solo de manera
parcial, está ahí, sujeta a procesos químicos que actúan sobre dichos
minerales. Sin ir demasiado lejos en el tiempo, en España existen cientos de
minas abandonadas (con sus escombreras y/o balsas asociadas, cuya explotación
cesó en el siglo 19 o 20. La inmensa mayoría de estas presentan riesgos
ambientales que aun no han sido evaluados o evaluados del todo. Por ejemplo,
sabemos de la presencia de antiguas explotaciones de plata en

Escombreras abandonadas y drenaje ácido en la antigua
explotación de Pb-Zn de San Quintín (Ciudad Real, España).
La metalurgia empleada en su momento para extraer el o
los metales de interés económico es otro de los temas de interés llegado el
momento de evaluar la peligrosidad de una explotación minera. En este sentido
conviene recordar los conceptos de “mena” y “ganga”. Puesto en términos muy
simples, mena es el o los minerales que presentan un interés económico en un
determinado momento por razones de mercado. Ganga es la fase mineral que carece
de dicho interés económico. De esta manera, para una compañía puede ser
interesante bajo el punto de vista económico explotar uno o dos minerales mientras
considera a un tercero como ganga. El problema radica en que pasa si este
último mineral contiene una fase metálica de alta peligrosidad ambiental. Por
ejemplo, un mineral típico presente en los yacimientos de sulfuros masivos de
Lo que no se dijo, o al menos no se explicitó en los
medios de comunicación, es que el vertido no incluía arsénico soluble (como
anión complejo), sino que el metal estaba principalmente fijado a la fase
sulfurada (arsenopirita). En estos casos la química ambiental puede llevar a
fuertes errores conceptuales si carece del obligatorio respaldo mineralógico.
Aun si el estudio químico de un vertido se realiza con la mejor intención del
mundo, la ignorancia (en el mejor de los casos) resulta inexcusable. ¿Significa
esto que el vertido de Aznalcóllar era inocuo? de ninguna manera, como hemos
visto en las reacciones anteriores, la arsenopirita acaba oxidándose, y
liberando complejos de arsénico:
2 FeAsS + Fe2(SO4)3
→ 2 H3AsO4 + 4 FeSO4 + H2SO4
Pero éste no es ni remotamente un proceso rápido, por lo cual la alarma inicial (con respecto a este elemento), inducida en parte por los medios de comunicación y grupos ambientalistas, era en algunos sentidos injustificada, y bastaba con remover la fracción sólida para alejar un peligro futuro cierto de contaminación por arsénico.
Un último apartado guarda relación con el clima. Si hablamos de la química de los procesos de oxidación, y de acidificación de cursos de agua (drenaje ácido), resulta obvio que la mayor o menor cantidad de lluvias o las temperaturas jugarán un papel importante. Por ejemplo, mientras menor la temperatura, más lenta la cinética de las reacciones, lo que significa que los procesos químicos tardan más en completarse. Así, en climas muy fríos los procesos de oxidación son en general poco eficaces. Por otro lado, un exceso de precipitaciones, como en las zonas tropicales, inducirá a una dilución de las soluciones, y por lo tanto la eficacia de los procesos químicos también se verá mermada. Como resulta obvio, precipitaciones muy escasas tampoco favorecerán los procesos de oxidación y lixiviación de metales. De ahí que los climas de tipo mediterráneo a semi-desérticos sean los más adecuados para favorecer este tipo de procesos: temperaturas medias-altas y precipitaciones no demasiado abundantes.
Aunque no se ha mencionado antes, existe otro factor
importante en estos procesos: la litología y los minerales de ganga. Por
ejemplo, las rocas (e.g. calizas) o minerales carbonatados (e.g. calcita) reaccionarán
con las soluciones ácidas neutralizándolas (reacciones solución-roca,
solución-mineral consumidoras de hidrogeniones), despojándolas así en gran
parte de su capacidad de lixiviación y transporte de metales.
El caso del arsénico es particularmente
significativo. Se trata de un elemento virtualmente “todoterreno” en los
ambientes acuáticos.